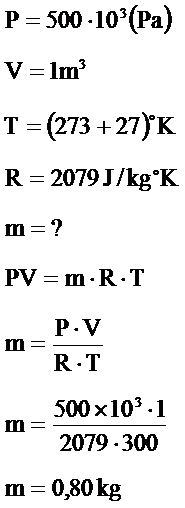Gaz Kanunları
Gaz Kanunları kimya alanında düşünülse de termodinamik ve enerji alanında da oldukça kullanılmaktadır. Gaz Kanunları lisede başlayıp üniversitede genişleyerek devam eder. Bu alanda bir pozisyonda çalışma imkanı bulursanız detaylarına çok daha fazla girmiş olursunuz.
Gaz kanunları, gazlardaki termodinamik sıcaklık (T), basınç (P) ve hacim (V) aralarındaki ilişkileri açıklayan bir takım kanundur. (Kaynak: Wikipedia)
GAZ KANUNLARI
Gazlar sıkıştırılabilen akışkanlar olarak tanımlanırlar. Yeryüzünü saran hava bir gaz karışımıdır. %78 Azot , % 21 Oksijen ve diğer gazlardan oluşmaktadır. Ayrıca endüstride oksijen , hidrojen , azot , karbondioksit , vb gazlar çeşitli uygulamalarda kullanılmaktadır.
Gazlar moleküllerden oluşmuştur. Moleküllerin ise, artan sıcaklığa bağlı olarak kinetik enerjileri dolayası ile hızları artmaktadır. Gaz akışkanları etkileyen diğer etmenler ise basınç ve hacimdir.
Basınç, gaz moleküllerinin kap çeperlerine yapmış oldukları vuruş etkileridir. Moleküller bulundukları kapların çeperlerine dik etki yaparlar.
Bu bölümde Boyle , Charles, basınç kanunları genel gaz eşitliği, kısmi basınçlar ve karakteristik gaz eşitlikleri incelenecektir.
BOYLE KANUNU
Diyagram 6.1
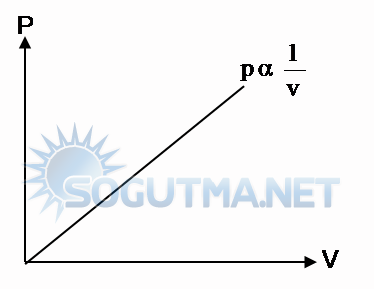
Sabit kütleli, sabit sıcaklıkta bir gaz maddenin hacmi ile basıncı ters orantılı olduğunun P-V diyagramında gösterilmesi.
Basınç ile hacminin çarpımıda sabittir.
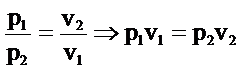
P.V=k
Tablo 6-1 ‘de örnek olarak değişik basınç ve değişik hacimlerdeki P.V çarpımlarının sabit olduğu görülmektedir.
| V(hacim) | P(basınç) | P:V |
| 48.0 | 1.00 | 48.0 |
| 38.0 | 1.27 | 48.3 |
| 23.0 | 2.10 | 48.3 |
| 13.0 | 3.70 | 48.1 |
Tablo 6.1
P.V çarpımlarının sabit olduğunun gösterilmesi
P.V çarpım değerlerindeki çok küçük değerlerde değiştikleri için bu değerleri sabit kabul edebiliriz. Ama çok yüksek basınçlarda ve çok düşük sıcaklıklarda boyle yasasından sapmalar olabilir. Aşağıdaki tablo buna bir örnektir.
|
P |
Azot(P:V) |
Karbondioksit(P.V) |
Hidrojen(P.V) |
|
1atm |
1.00 |
1.00 |
1.00 |
|
50atm |
0.9846 |
0.7413 |
1.033 |
|
200atm |
1.0365 |
0.4087 |
1.1336 |
|
400atm |
1.2557 |
0.7178 |
1.2775 |
|
1000atm |
2.0641 |
1.5525 |
1.7107 |
Tablo 6.2
Çok büyük basınçlarda P.V sabitinin değişmesi
Gerek boyle ve gerekse ileride anlatacağımız yasalara tamamen uyan gazlara ideal gaz bu yasaya uymadığı durumlardaki davranışlar için ise gaz gerçek gaz niteliğindedir denir.
Örnek Problem 1
70cm Hg basıncında 850 cm3 olan bir gaz ,sıcaklık sabit tutularak hacmi 720cm3 olacak şekilde bastırıldığında, basıncının ne kadar artacağını hesaplayınız ?
Çözüm
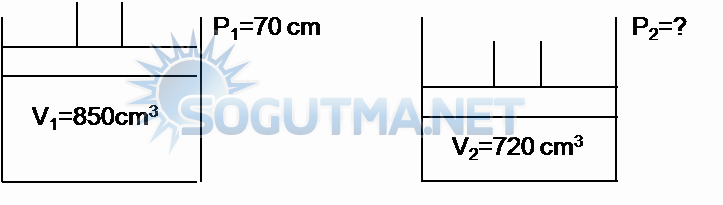
Şekil 6.1
Sıcaklığın soğuk tutulabilmesi için silindir soğutulur.
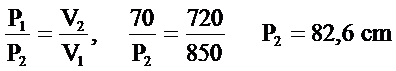
Basıncın artan miktarı= 82.6-70.0=12.6 cm civa basıncıdır.
Örnek Problem 6.2
Sabit sıcaklıkta ve belirli miktarda gazın 500mmHg basıncında işgal ettiği hacim 11.20 lit ‘dir. Gazın basıncı 750mm Hg basıncına yükseltilirse son hacim ne olur?
Çözüm
Şekil 6.2
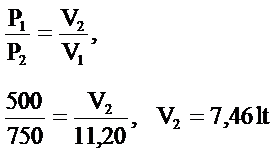
Örnek Problem 6.3
Sabit sıcaklıkta ve belirli miktarda gazın 450mmHg basıncında işgal ettiği hacim 10,50 lit’dir. Gazın basıncı 700mmHg basıncına yükseltilirse son hacmi ne olur?
Çözüm:

Şekil 6.3
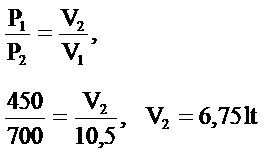
Charles kanunu
Bir gazın sıcaklığı değiştirilirse o gazın ya hacmi ,ya basıncı ya da her ikisi de değişebilir. Gazların sabit kütlede ve sabit basınçta sıcaklığı ile hacmi doğru orantılı olarak değişmektedir. Bir gazın çeşitli sıcaklıklarda hacimleri seri deneylerle tayin edilerek, bir grafik çizilecek olursa düzgün doğru elde edilir.
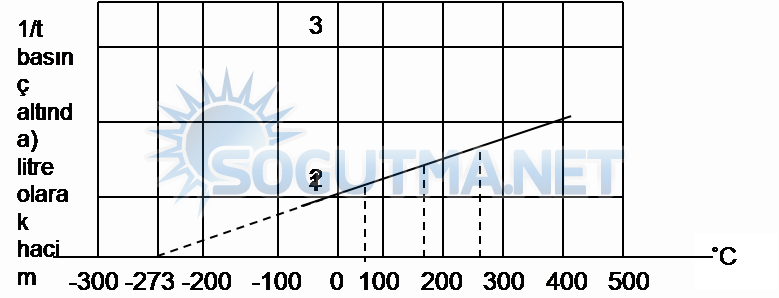
Grafik 6.1
Sabit kütle ve basınçta hacim sıcaklık ilişkisi
Elde edilen doğrunun eğimi deneyde kullanılan gazın hacmine bağlıdır.(Grafik 6.1) incelenirse nokta nokta gösterillen kısım ölçü yapılması mümkün olmayan sıcaklıklar sınırıdır. Sıcaklık sıfır olduğu zaman gazın hacmi sıfır değildir. Uzatılan doğru sıcaklık eksenini -273°C ‘de keser. Bu nokta erişilebilen en düşük sıcaklık olup, bu sıcaklıkta gazın molekülleri arasındaki hacmi sıfır olmaktadır.-273°C ‘de hiç bir madde gaz halinde bulunamaz.
Charles kanununda sabit kütlede ve sabit basınçta bir gazı sıcaklığı ile hacmi doğru orantılı olarak değişir.
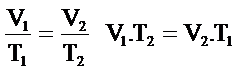
Örnek Problem 6.4
Sabit kütlede ve sabit basınçta bir gaz birincide hacmi 750 cm3‘te ve 80°K’dir. Hacmi 850cm3 ‘e çıkarılırsa sıcaklığı ne olur?
Çözüm:
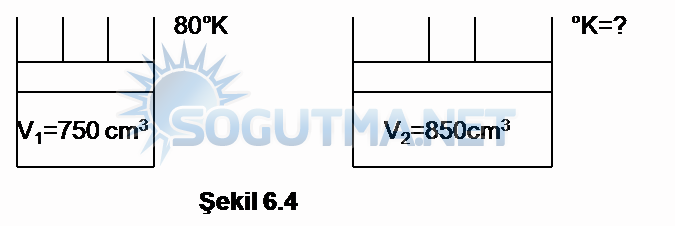
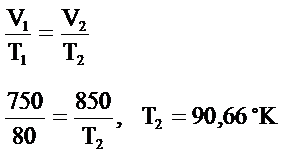
Örnek Problem 6.5
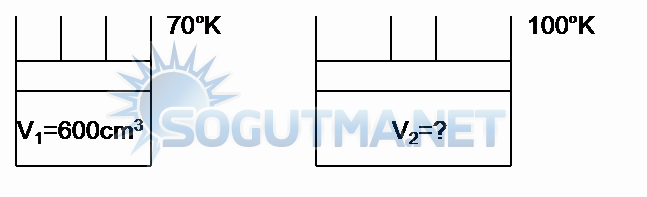
Sabit kütlede ve sabit basınç bir gaz birinci ölçümde 600cm3 hacme sahip ve 70°K ‘dir. İkinci ölçümde sıcaklığı 100°K ‘dir. Hacmi ne kadardır?
Çözüm
Şekil 6.5
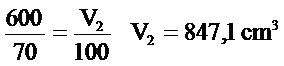
GAY-LUSSAC KANUNU
Şekil 6.6
Kütlesi ve hacmi sabit tutulan bir gazın basınç ve sıcaklık ilişkisi
Bir kap içinde bulunan gazın basıncı gaz ısıtılırsa artar. Basınç ve sıcaklık arasındaki matematiksel bağıntı, hacim ve sıcaklık arasındaki bağıntıya benzer. Hacim sabit tutulduğunda, bir gazın basıncı doğrudan mutlak sıcaklık ile değişir.
Bu durumda k ‘nın değeri incelenen gazın miktarına ve hacmine bağlıdır. Bu genelleme bazen Amontos yasası olarak ta isimlendirilir.

Şekil 6.7
Sıcaklık değişiminin basınç değişimine etkisi.
Resim 6-7 ‘de görüldüğü gibi SO2, CH3CI ve R-12 gazlarının basınç sıcaklık ilişkisi görülmektedir.
SO2 gazı +20°C sıcaklıkta basıncı 2,37 atü iken, -10°C sıcaklığında 0 atülük basınç değerinde ,+30°C ‘de ise basıncı 5,7 atü’dür.
CH3CI ‘de ise +20°C sıcaklıkta basınç 4,0 atü iken –24 °C sıcaklığında 0 atülük basınç değerinde, +30°C ‘de ise basıncı 5,7 atü’dür.
R-12 gazı +20°C sıcaklıkta basıncı 4,78 atü iken, -30°C’ de sıcaklıkta 0 atü değerinde, +30°C ‘de ise basıncı 6,57 atü ‘dür. Sabit hacim ve kütlede gazların basıncı arttıkça sıcaklığı da artmakta, basınç azaldıkça sıcaklığında azalmakta olduğu Resim 6-1 ‘de görülmektedir.
Örnek Problem 6.6
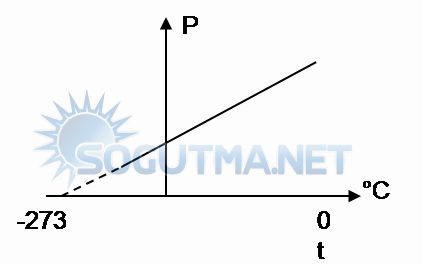
Bir çelik kap içinde 380mmHg basıncında, -73°C sıcaklıkta He gazı vardır. Bu gazın basıncını, 570 mmHg basıncına çıkardığımızda sıcaklığı kaç °C olur?
Çözüm
Şekil 6.8
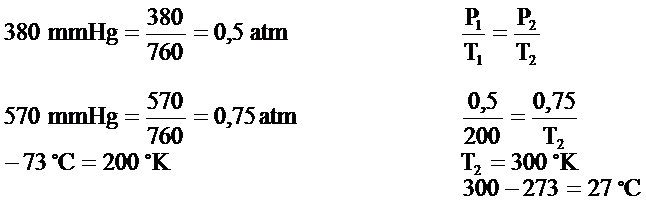
Örnek Problem 6.7
Bir çelik kap içinde450mm Hg basıncında -60°C sıcaklıkta CO2 gazı vardır. Bu gazın sıcaklığını 10°C sıcaklığına çıkardığımızda çelik kap içindeki basıncı hesaplayınız?
Çözüm
Şekil 6.9
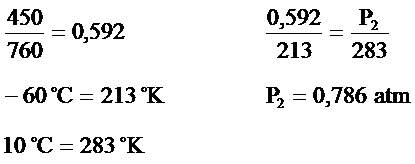
GAZLARIN GENEL DENKLEMİ
Gazaların genelde en çok karşılaşılan durumu basınç, sıcaklık ve hacim değişkenlerin her üçünün de değişimidir. Bu durum aşağıdaki eşitlikle ifade edilir.
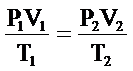
Birinci durumdaki toplam değer, ikinci durumdaki toplam değerle aynıdır. Sadece değişen basınç, hacim ve sıcaklık değerleridir.
Genel gaz denklemi Gay- Lusac, Boyle ve basınç kanunlarının en son şeklidir.
Örnek Problem 6.8
Birinci durumda bir gazın basıncı 5Mpa,hacmi 2m3 sıcaklığı ise 20°C ‘dir. ikinci durumda gazın basıncı 8Mpa ‘a çıkarılmakta; hacmi ise 1m3’e düşmektedir. Buna göre gazın ikinci durumdaki sıcaklığını bulunuz?
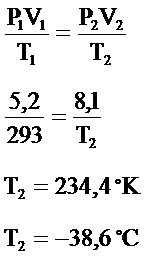
DALTONUN KISMİ BASINÇ KANUNU
Dalton’un kısmi basınç kanunu sabit sıcaklıkta belirli hacimdeki gaz karışımlarının kaba uyguladıkları basınç toplamı, her bir gazın kaba tek tek yapmış oldukları basınca eşittir.
Şekil 6-10’da görüleceği gibi bir kap içine azot ve hidrojen gazı birlikte konuluyor. Her iki gazın kaba yaptıkları basınç, her birinin tek tek yaptıkları basınca eşittir.
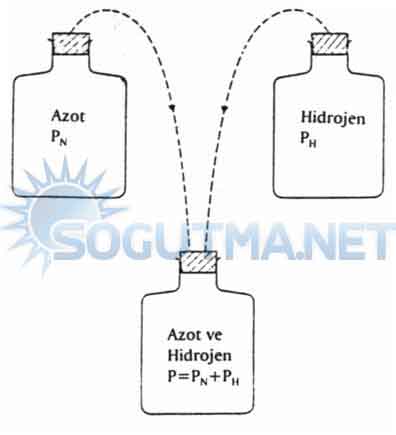
Şekil 6.10
Dalton’un Kısmi Basınçlar kanunu
PT = PN+PH
Örnek Problem 6.9
Bir kap içinde azot ve hidrojen gazları bulunmaktadır. Her iki gazın kaba yapmış oldukları basınç değeri 10Mpa’dır. Kap içinde tek azot bulunduğunda kaba yaptığı basınç 3Mpa olduğuna göre hidrojenin kaba yaptığı basıncı hesaplayınız?
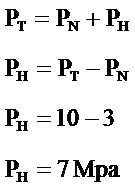
KARAKTERİSTİK GAZ EŞİTLİĞİ
Genel gaz denkleminde ifade edildiği gibi bir yazın sıcaklığı basıncı ve hacmi sonsuz sayıda değiştirilse de sonuçta sabit bir sayıya ulaşır.
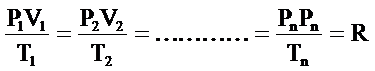
Her gaz için farklı ve sabit olan bir sayıya gaz sabitesi denir. Her gazın sabitesi farklıdır. Sabite birim kütle için dikkate alındığında buna karakteristik gaz sabitesi denir. R ile gösterilir.
Birim iş J/kg˚K veya j/kg˚C’dir.
Sonuçta eşitlik aşağıdaki gibi düzenlenir.
PV/T x m = R olduğunda eşitlik
P.V = m.R.T şeklinde oluşur.
P = Mutlak Basınç (Pa)
V = Hacim (M3)
m = Kütle(kg)
R = Gaz sabitesi (J/kg˚K)
T = Sıcaklık (˚K)
Oksijen gaz sabitesi: Ro = 203 J/kg
Havanın gaz sabitesi: Rhava = 288 J/kg
Helyumun gaz sabitesi :Rhe = 2079 J/kg
Hidrojen gaz sabitesi :Rh = 4157 J/kg
Örnek Problem 6.10
0,9m3 hacme sahip bir tankın içinde 15˚C sıcaklıkta 520kPa basınçta helyum ve hidrojen gazı bulunmaktadır. Helyum gazının kütlesi 0,5kg olduğuna göre:
- Her bir gazın ayrı ayrı yaptıkları kısmi basınç değerlerini;
- Hidrojen gazının kütlesini hesaplayınız?
- Helyumun tek basına yapacağı basınç;
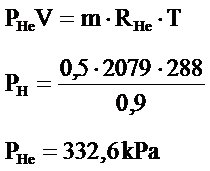
Hidrojenin yaptığı basınç Dalton Kanuna göre;
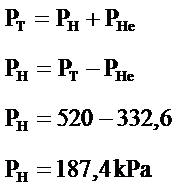
- Hidrojen gazının kütlesi;
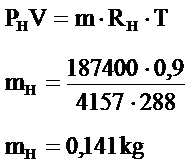
Örnek Problem 6.11
1m3 hacme sahip bir tankın içinde 27˚C sıcaklıkta , 500 kPa basınçta gaz bulunmaktadır. Gazın karakteristik gaz sabiti 2079 j/kg˚K’dır. Kap içindeki gazın kütlesini hesaplayınız?