Saf Maddenin Özellikleri
Saf Madde, termodinamik ve bir çok enerji konusunda karşımıza çıkmaktadır. Saf Madde konusunu ilk olarak 4. sınıfta görür iken üniversitede çok daha detaylı ve kapsamlı olarak ele alınmaktadır.
Saf madde tanımında bulunan element ve bileşik altın ve su görselleri ile betimlenerek saf madde tanımı verilir. (Kaynak: Eba ) Soğutucu akışkanlar ve termodinamik kanunlar olarak ele aldığımızda oldukça geniş bir kapsama sahiptir.
SAF MADDE
Her noktasında aynı ve değişmeyen bir kimyasal bileşime sahip olan maddeye saf madde adı verilir. Su, azot, helyum, hidrojen, karbondioksit, saf maddedir
Saf maddenin sadece bir tek kimyasal element veya bileşiminden oluşması gerekmez .Değişik kimyasal elementlerden veya bileşimlerden oluşan bir karışımda, homojen olduğu sürece saf madde kabul edilir. Hava değişik gazlardan oluşan bir karışımdır, kimyasal bileşimi her noktada aynı ve değişmez olduğu için saf maddedir.

Şekil 4.1
Azot ve gaz hava birer saf maddedir.
Su ve yağ karışımı saf bir madde sayılamaz, çünkü böyle bir karışımda yağ, suda çözülmeyip üstte toplandığından homojen bir kimyasal karışım oluşturmazlar.
Saf bir maddenin iki veya daha çok fazının bir arada bulunduğu bir karışımda, fazların kimyasal bileşiminde bir farklılık olmadığı sürece saf madde kapsamına girer. Sıvı buhar karışımı saf bir maddedir, çünkü her iki fazında kimyasal bileşimi aynıdır. Buna karşılık sıvı hava ile gaz havanın oluşturduğu karışım saf madde değildir, çünkü sıvı havanın kimyasal bileşimi gaz havanınkinden farklıdır. Bunun nedeni, havayı oluşturan gazların değişik yoğuşma sıcaklıklarına sahip olmalarıdır.
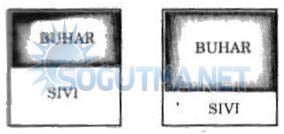
Şekil 4.2
Sıvı buhar karışımı su saf bir maddedir, fakat sıvı ve gaz havanın karışımı saf bir madde değildir
SAF MADDENİN FAZLARI
Maddeler değişik şartlarda farklı fazlarda bulunabilir. Oda sıcaklığında ve basıncında bakır katıdır, civa sıvıdır, azot ise gazdır. Temelde katı,sıvı ve gaz olmak üzere üç grup faz vardır. Fakat her temel faz içinde farklı molekül düzenine sahip başka fazlarda olabilir. Örnek olarak karbon, katı fazı içinde grafit veya elmas fazlarında bulunabilir. Yüksek basınçlarda buz yedi değişik fazda bulunabilir. Faz, fiziksel olarak belirgin sınırların içinde her noktada aynı olan belirli bir molekül düzenini simgeler. Buzlu su, suyun iki fazını açıklayıcı iyi bir örnektir.
Katı fazında moleküller latis adı verilen ve kendini tekrarlayan üç boyutlu bir düzende yer almaktadır.
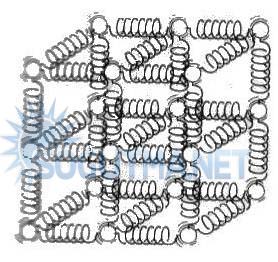
Şekil 4.3
Katı bir cismi oluşturan molekülleri, yay benzeri molekülleri arası kuvvetlerle yerlerinde tutulurlar.
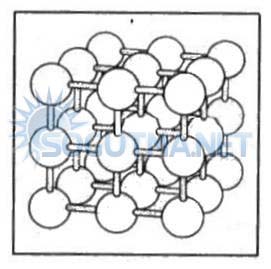
Şekil 4.4
Katı fazında moleküller yerlerinde hemen hemen sabittir.
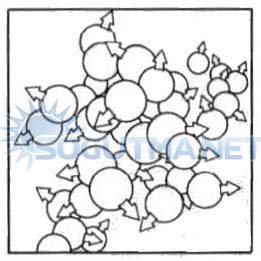
Şekil 4.5
Sıvı fazında molekül kümeleri birbiri üzerinden akar.
Şekil 4.6
Gaz fazında molekülleri rastgele bir hareket içindedir.
SAF MADDELERİN FAZ DEĞİŞTİRDİKLERİ HAL DEĞİŞİMLERİ
Saf madenin iki fazının bir arada bulunduğu durumlarla sık karşılaşırlır. Su bir kazanda veya buharlı güç santralinin yoğuşturucusunda sıvı buhar karışımı olarak bulunur. Buzdolabının soğutucusunda soğutucu akışkan, sıvıdan buhara dönüşür.
Sıkıştırılmış Sıvı

Şekil 4.7
1 atm basınç ve 20°C sıcaklıkta su sıvı fazındadır. (Sıkıştırılmış sıvı)
Doymuş Sıvı

Şekil 4.8
1 atm basınç ve 100˚C sıcaklıkta su buharlaşma basıncında sıvıdır (Doymuş sıvıdır.)
Doymuş Buhar
Buharlaşma başladıktan sonra, sıvının tümü buhara dönüşene kadar sıcaklıkta bir artış olmayacaktır. Başka bir deyişle, faz değişimini kapsayan hal değişiminin tamamı süresince sıcaklık sabit kalacaktır. Bu işlemler sabit basınçta olması gerekir. Piston silindir düzeneğine geri dönersek, buharlaşma sürecinin ortalarında, silindirin içinde yarı yarıya sıvı ve buhar olacaktır. (Şekil 4.9) 3 hali Isıtma işlemi sürdürülürse, tüm sıvı buhara dönüşür.

Şekil 4.9
Isıtma sürdürüldüğünde doymuş sıvının bir bölümü buharlaşır. (Doymuş sıvı buhar karışımı).
Isıtma işlemesi sürdürülürse, tüm sıvı buhara dönüşür. Şekil (4.10.) 4 hali. Bu noktada silindirin içi yoğuşmanın sınırında buharla doludur. Buhardan çevreye azda olsa ısı geçişi bir miktar buharın yoğuşmasına (buhardan sıvıya dönüşmesine) yol açacaktır. Yoğuşmanın sınırında olan bu buhara doymuş buhar adı verilir.
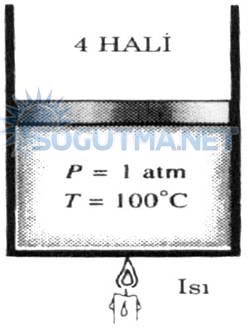
Şekil 4.10
1 atm basınçta, sıvının son damlasıda buharlaşana kadar , sıcaklık 100°C sabit kalır (doymuş buhar.)
Kızgın Buhar
Silindir içerisindeki suyun 100°C’de tamamı buharlaştıktan sonra ısıtma işlemi sürdürülürse sıcaklık ve özgül hacminin artığı gözlenecektir. (Şekil 4.11) 5 halinde buharın sıcaklığı örneğin 300°C olabilir. Bu halde buhardan biraz ısı çekersek sıcaklık düşer fakat yoğuşma olmaz. Yoğuşma sınırında olmayan buhara kızgın buhar denir.

Şekil 4.11
Isıtma sürdürülürse,buharın sıcaklığı yükselmeye başlar (kızgın buhar).

Diyagram 4.1
Suyun sabit basınç altında ısıtılmasının T-V diyagramında gösterilmesi.
Doyma Sıcaklığı ve Doyma Basıncı
Verilen bir basınçta saf maddenin kaynamaya başladığı sıcaklık doyma sıcaklığı Tdoyma olarak tanımlanır. Benzer biçimde, verilen bir sıcaklıkta, saf maddenin kaynamaya başladığı basınç ise doyma basıncı, Pdoyma olarak tanımlanır. 101,35 kpa basınçta suyun doyma sıcaklığı 100°C’dir. Doğal olarak 100°C’de suyun doyma sıcaklığı doyma basıncında 101,35 kpa olur.
Açıkça görüldüğü gibi, faz değişimin gerçekleştiği bir hal değişimi sırasında sıcaklık ve basınç birbirine bağlı özelikleridir. Tdoyma =f(Pdoyma) olur. Doyma sıcaklığını doyma basıncına göre değişimi veren eğri sıvı-buhar doyma eğrisi diye adlandırılır. Su için bu ilişkiyi gösteren eğri diyagram 4.2’de verilmiştir. Tüm saf maddelerin sıvı-buhar doyma eğriliri buna benzer özellikle gösterir.
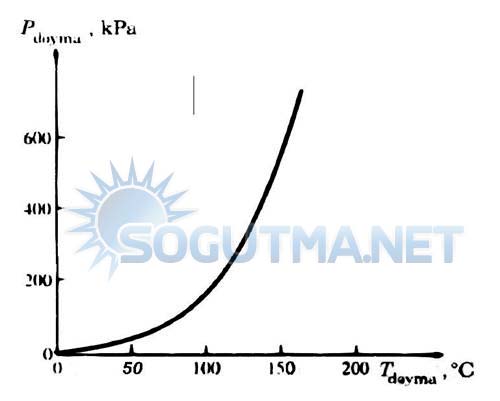
Diyagram 4.2
Saf maddenin sıvı buhar doyma eğrisi (sayısal değerler su içindir).
Diyagram 4.2 incelendiğinde, doyma sıcaklığının doyma basıncıyla yükseldiği görülmekte yani basınç artıkça kaynama noktası sıcaklığı yükselmektedir.
Atmosfer basıncı ve dolayısıyla suyun kaynama sıcaklığı yükseklikle azalır. Bu bakımdan, eğer düdüklü tencere kullanılmıyorsa, yüksek yerlerde yemeklerin pişirme süresi daha uzun olacaktır. Atmosfer basıncının ve suyun kaynama sıcaklığının yükseklikle değişimi çizelge 4.1’de gösterilmiştir. Her 1000m yükseklik artışı için kaynama sıcaklığı yaklaşık 3°C düşmektedir.
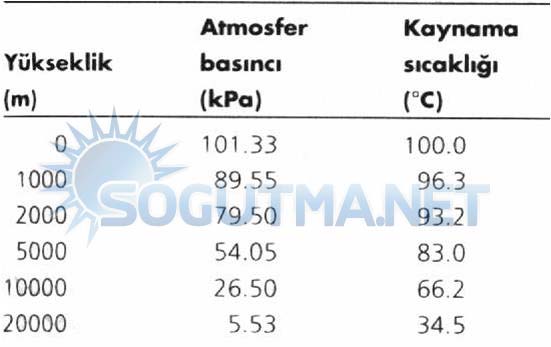
Çizelge 4.1
Standart atmosfer basıncının ve suyun kaynama (doyma) sıcaklığının yükseklikle değişimi.
Kritik Sıcaklık
Doymuş sıvıyla doymuş buhar hallerinin aynı olduğu hal olarak tanımlanır. Bir maddenin kritik noktada sahip olduğu sıcaklık, basınç ve özgül hacim değerleri sırasıyla kritik sıcaklık, Tkr, kritik basınç Pkr ve kritik özgül hacim, Vkr diye adlandırılır. Su için kritik nokta değeri Tkr=374,14°C ,Pkr=22,09 Mpa ve Vkr=0,003155 m3/kg dır.
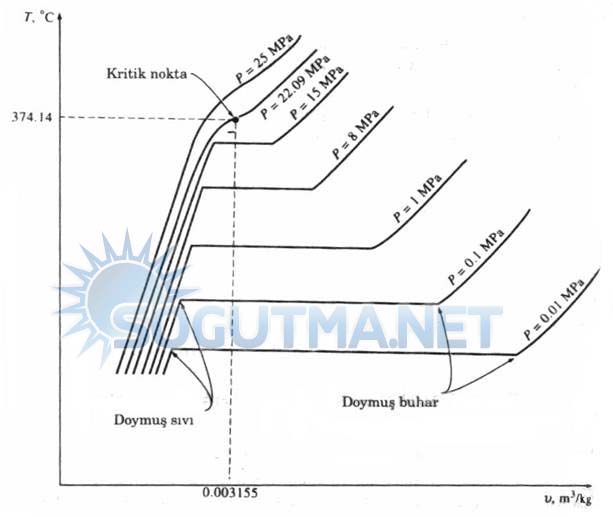
Değişik basınçlar için saf maddenin saf basınçtan faz değişimi eğrilerinin T-V diyagramında gösterimi
( Sayısal değerler su içindir).
Kritik basıncın üzerindeki basınçlarda belirgin bir faz değişimi görülmez. Diyagram 4.3 Bunun yerine maddenin özgül hacmi sürekli olarak artar ve sürekli aynı fazda bulunur. Genellikle kritik sıcaklığın üzerindeki sıcaklıklarda maddeye kızgın buhar, kritik sıcaklığın altındaki sıcaklıklarda maddeye sıkıştırılmış sıvı denir.
Diyagram 4.3‘de doymuş sıvı hallerini gösteren noktalar birleştirildiği zaman doymuş sıvı eğrisi elde edilir. Benzer olarak doymuş buhar halleri birleştirilerek doymuş buhar eğrisi çizilebilir. Bu iki eğri diyagram 4-6‘da görüldüğü gibi kritik noktada birleşerek bir kubbe oluşturulur. Tüm sıkıştırılmış sıvı halleri doymuş sıvı eğrilerinin solunda kalır. Bu bölge sıkıştırılmış sıvı bölgesi diye adlandırılır. Tüm kızgın buhar bölgeleri doymuş buhar eğrisinin sağında kalır. Bu bölgeye kızgın buhar bölgesi adı verilir. Madde bu iki bölgede sadece sıvı veya sadece buhar fazındadır. Her iki fazın bir arada dengede bulunduğu hallerin tümü kubbenin altında, doymuş sıvı- buhar karışımı bölgesi veya ıslak buhar bölgesi adı verilen bölgedir.
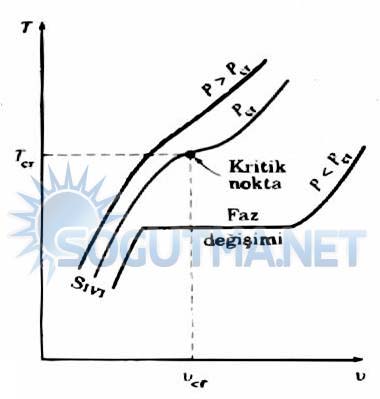
Diyagram 4.4
Kritik basıncın üzerindeki basınçlarda (P>PCR) belirgin bir faz değişimi (kaynama ) süreci yoktur.
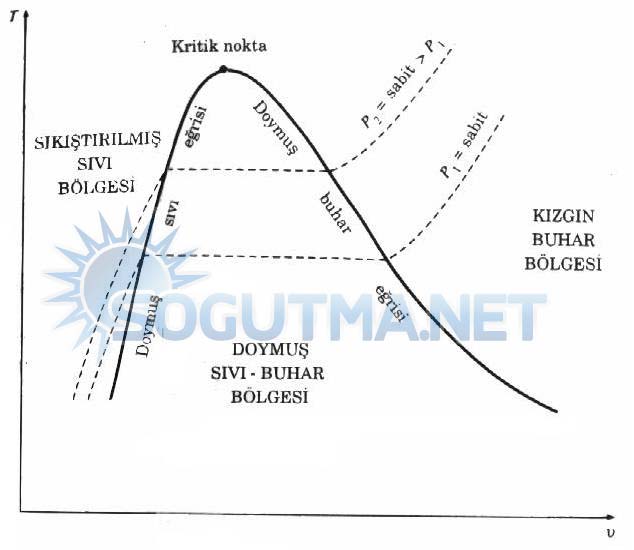
Diyagram 4.5
Saf maddenin T-V diyagramı
Saf Bir Maddenin P-T Diyagramı
Bu diyagram genellikle faz diyagramı olarak bilinir, çünkü her üç faz birbirlerinden bir eğriyle ayrılmıştır. Süblimasyon eğrisi katı ve buhar bölgelerini ayırır, ergime eğrisi de katı ve sıvı bölgelerine ayırır. Bu üç eğri, her üç fazın birarada dengede olduğu üçlü noktada buluşur. Buharlaşma eğrisi kritik noktada sona erer. Çünkü kritik noktanın üzerinde sıvı ve buhar fazları arasında bir ayrım yapılamaz.

Diyagram 4.6
Saf maddenin P-T diyagramı



